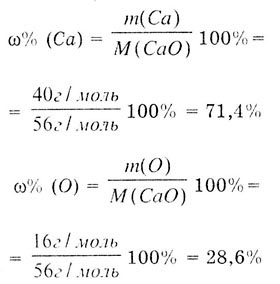
Закон постоянства состава вещества является одним из фундаментальных принципов химии. Он утверждает, что в химической реакции массовое соотношение между элементами вещества остается неизменным. Это значит, что количество атомов каждого элемента находится в строго определенном отношении, независимо от того, какие конкретные вещества принимают участие в реакции.
Идея закона постоянства состава была сформулирована Джоном Дальтоном в начале XIX века и стала одной из основ химической теории. Согласно этому закону, 1 моль вещества всегда содержит определенное количество атомов каждого элемента, которое можно выразить числовыми соотношениями. Например, водные растворы серной кислоты всегда содержат 1 моль серы, 2 моля водорода и 4 моля кислорода.
Закон постоянства состава позволяет проводить точные расчеты химических реакций и предсказывать их результаты. Также он является основой для разработки и использования химических формул, позволяющих описывать соединения и реакции. Этот закон согласуется с другими фундаментальными принципами химии, включая закон сохранения массы и закон множественных пропорций.
Вещество и его состав в химии
В химии вещество можно определить как материальный объект, который имеет массу и занимает определенный объем в пространстве. В то же время вещество состоит из атомов или молекул, которые могут быть разделены на элементарные составляющие частицы, такие как протоны, нейтроны и электроны.
Состав вещества включает в себя типы и количество элементов, которые присутствуют в данном веществе. Химическая формула вещества представляет собой символы элементов и их соотношения в данной молекуле или структуре. Например, вода (H₂О) состоит из двух атомов водорода (H) и одного атома кислорода (O).
В химии существуют различные методы анализа и определения состава вещества. Спектроскопические методы позволяют определить типы атомов, присутствующих в образце, а также их относительное количество. Хроматография используется для разделения смесей веществ на компоненты и определения их соотношения. Физические методы, такие как измерение плотности или массы, также могут быть использованы для определения состава вещества.
- Например, воздух состоит в основном из азота (около 78%) и кислорода (около 21%), а также содержит следовые элементы, такие как аргон, углекислый газ и водяной пар.
- Состав железной руды может варьироваться, но обычно он содержит около 70% железа и разные примеси, такие как кремний, алюминий и фосфор.
- Скелет человека состоит преимущественно из кальция (около 2% от общей массы) и фосфора (около 1% от общей массы), а также содержит другие элементы, такие как натрий, калий и магний.
Понимание состава вещества является основой для понимания его свойств и реакций. Закон постоянства состава вещества утверждает, что состав вещества остается неизменным в химических реакциях, при условии, что нет потерь или добавления новых веществ. Этот закон позволяет химикам предсказывать и объяснять результаты химических реакций и разрабатывать новые соединения и материалы.
Принципы химического состава
В химии существует основной принцип, известный как закон постоянства состава вещества. Этот закон гласит, что массовое соотношение элементов, входящих в химическое соединение, всегда остается неизменным.
Принцип закона постоянства состава вещества можно объяснить следующим образом:
- Вещество состоит из атомов элементов, которые имеют определенную массу.
- Химическое соединение образуется путем соединения атомов в определенном соотношении.
- Масса каждого элемента в составе вещества остается неизменной при любых химических реакциях.
Принцип закона постоянства состава вещества является фундаментальным принципом химии и является основой для многих химических расчетов и экспериментов.
Примеры принципа химического состава:
- Вода всегда состоит из двух атомов водорода и одного атома кислорода, в массовом соотношении 2:1.
- Аммиак всегда содержит один атом азота и три атома водорода, в массовом соотношении 1:3.
- Углекислый газ всегда состоит из одного атома углерода и двух атомов кислорода, в массовом соотношении 1:2.
Эти примеры подтверждают, что закон постоянства состава вещества соблюдается и позволяет определять массовое соотношение элементов в химических соединениях на основе их химических формул.
Атомы и молекулы
Молекулы образуются, когда два или более атомов соединяются химическими связями. Химические связи между атомами в молекуле могут быть ковалентными, ионными или металлическими, в зависимости от типа атомов, которые участвуют в образовании связи.
Атомы различных элементов имеют разные свойства и реактивность. Например, атомы кислорода и водорода соединяются, чтобы образовать молекулу воды. Этот процесс происходит в соответствии с законом постоянства состава, что означает, что количество и тип атомов в исходных веществах должно быть равно количеству и типу атомов в конечных веществах.
Изучение атомов и молекул позволяет нам понять, как химические реакции происходят и как формируется и изменяется состав вещества. Закон постоянства состава является фундаментальным принципом химии и позволяет установить связь между микроскопическими свойствами атомов и макроскопическими свойствами вещества.
Массовая доля компонентов
Массовая доля вычисляется путем деления массы каждого компонента на общую массу образца и умножения результата на 100%. Массовая доля обычно выражается в процентах.
Например, представим образец смеси, состоящей из 50 г алюминия (Al) и 50 г меди (Cu). Общая масса образца составляет 100 г. Массовая доля алюминия будет:
- Масса алюминия: 50 г
- Общая масса: 100 г
- Массовая доля алюминия: (50 г / 100 г) * 100% = 50%
Таким образом, массовая доля компонента позволяет определить, насколько важен каждый элемент для состава вещества и проводить различные расчеты, связанные с его присутствием в образце.
Закон постоянства состава
Этот закон гласит о том, что отношение массы каждого элемента к общей массе вещества остается неизменным при всех химических реакциях. Например, массовая доля углерода (С) в углекислом газе (CO2) всегда будет составлять 27,3%, а массовая доля кислорода (О) – 72,7%.
Закон постоянства состава был впервые сформулирован в 1799 году Джозефом Люи Гай-Люссаком, и с тех пор он стал основополагающим в химических исследованиях и промышленности.
Этот закон играет ключевую роль в различных областях химии, включая аналитическую химию, синтез химических соединений и расчеты массовых пропорций при проведении реакций. Знание закона постоянства состава позволяет предсказывать результаты химических реакций и определять количество веществ, необходимых для получения желаемого продукта.
Таким образом, закон постоянства состава играет важную роль в понимании и исследовании химических процессов, способствуя развитию науки и промышленности.
Примеры из практики
- Сгорание бумаги: когда бумага горит, она соединяется с кислородом из воздуха и превращается в углекислый газ и воду. При этом масса углекислого газа и воды, образующихся в результате сгорания, в сумме будет равна массе исходной бумаги.
- Растворение соли: если добавить кристаллы соли в воду и перемешать, то соль растворится, а образовавшийся раствор будет состоять из ионов натрия и хлорида. Закон постоянства состава указывает, что масса всех ионов натрия и хлорида в растворе должна быть равна массе исходной соли.
- Перегонка нефти: при перегонке нефти на разные фракции, исходная нефть разлагается на компоненты различного состава. Несмотря на это, закон постоянства состава гарантирует, что суммарная масса всех продуктов перегонки будет равна массе исходной нефти.
- Комбинирование химических реагентов: при химической реакции, например, синтезе аммиака из азота и водорода, масса образовавшегося аммиака будет равна сумме масс исходных реагентов. Закон постоянства состава подтверждает, что ни один атом не создается или не уничтожается во время химической реакции.
Это лишь некоторые примеры того, как закон постоянства состава вещества применяется на практике. Общая идея состоит в том, что масса исходных веществ всегда будет равна массе образовавшихся продуктов реакции, что подтверждает сохранение атомов и ионов в химических процессах.
Синтез органических соединений
Синтез органических соединений основан на законе постоянства состава вещества, согласно которому количество и соотношение атомов в реагентах и продуктах синтеза всегда должно быть одинаковым.
Для синтеза органических соединений могут использоваться различные методы, включая реакции замещения, присоединения, окисления, восстановления, расщепления и др.
Примером синтеза органического соединения является синтез ацетилсалициловой кислоты, известной как аспирин. Этот препарат широко используется в медицине как анальгетик, жаропонижающее и противовоспалительное средство. Синтез аспирина происходит из салициловой кислоты и уксусного ангидрида при наличии катализатора.
Синтез органических соединений – сложный и многоэтапный процесс, требующий специальных знаний и навыков. Он является основой для создания новых лекарственных препаратов, пластиков, красителей и многих других продуктов, которые широко используются в нашей повседневной жизни.
Лавосье и его эксперименты
Одним из самых известных экспериментов Лавуазье был его опыт с железным воздухом. Он нагрел железную чашку и поместил ее в закрытую емкость с воздухом. Через некоторое время он заметил, что воздух стал поглощаться металлом и образовалась твердая красная корка. Лавуазье подтвердил, что воздух состоит из двух компонентов — кислорода и азота, и что при нагревании железом кислород поглощается, а азот остается неизменным. Этот эксперимент подтвердил концепцию Лавуазье о постоянстве состава вещества.
Другим экспериментом Лавуазье было его исследование дыхания животных. Он заметил, что животные вдыхают кислород и выделяют углекислый газ, и что количество кислорода, потребляемого животными, равно количеству выделяемого углекислого газа. Это подтвердило закон постоянства состава вещества и помогло Лавуазье формулировать свою теорию о жизненно важных реакциях в организмах.
Еще одним важным экспериментом Лавуазье было его исследование горения и дыхания. Он провел серию опытов с горением различных веществ, включая древесные опилки, уголь и серу. Лавуазье обнаружил, что при горении вещества соединяются с кислородом и формируют новые вещества, а объемы газов, выделяемых в результате, равны количеству газов, поглощаемых веществом в процессе дыхания. Эти эксперименты подтвердили закон постоянства состава вещества во время химических реакций.
Благодаря своим экспериментам Лавуазье смог установить основные принципы закона постоянства состава вещества. Его работа стала основой для развития современной химии и изменила наше понимание о природе химических реакций.
Вопрос-ответ:
Что такое закон постоянства состава вещества в химии?
Закон постоянства состава вещества в химии утверждает, что в конкретном химическом соединении массовые отношения элементов всегда остаются неизменными, независимо от способа получения соединения.
Какой пример можно привести для закона постоянства состава вещества в химии?
Хорошим примером закона постоянства состава вещества может служить соединение воды (H2O). Независимо от метода получения воды, массовое соотношение водорода и кислорода всегда будет 2:1.
Влияет ли закон постоянства состава вещества на химические реакции?
Да, закон постоянства состава вещества оказывает влияние на химические реакции. Он указывает, что массовые отношения элементов в реагентах и продуктах реакции остаются неизменными.
Что такое закон постоянства состава вещества в химии?
Закон постоянства состава вещества в химии утверждает, что в химической реакции общая масса реагирующих веществ равна общей массе образовавшихся веществ. Это значит, что в процессе химической реакции атомы не создаются и не уничтожаются, а только переупорядочиваются, образуя новые соединения.
Какие принципы лежат в основе закона постоянства состава вещества в химии?
Закон постоянства состава вещества основан на двух основных принципах: массовом действии и составе вещества.