Второй закон термодинамики, также известный как закон энтропии, является одним из основных принципов физики, описывающих поведение тепловых систем. Этот закон утверждает, что в изолированной системе энтропия всегда увеличивается или остается постоянной, но никогда не уменьшается. Это означает, что система всегда стремится к равновесию и хаосу.
Роль второго закона термодинамики в природе невозможно переоценить. Этот закон объясняет множество явлений и процессов, происходящих в окружающей нас среде. Например, он помогает понять, почему чашка с горячим кофе остывает со временем, а не нагревается сама по себе. Или почему природные процессы всегда направлены от упорядоченности к более хаотичному состоянию.
Второй закон термодинамики также имеет важное значение в технологиях. Он ограничивает эффективность всех машин и устройств, использующих тепловую энергию. Например, двигатели внутреннего сгорания и электростанции не могут быть 100% эффективными из-за потерь энергии в виде тепла. Второй закон термодинамики помогает инженерам и ученым разрабатывать более эффективные и экологически чистые технологии.
Интересно, что второй закон термодинамики также имеет отношение к социальным, экономическим и биологическим системам. Например, он может использоваться для объяснения процессов старения организма или эволюции живых организмов. Второй закон термодинамики дает нам общую картину о том, как все в природе стремится к равновесию и как энтропия влияет на развитие систем.
Второй закон термодинамики
Энтропия – это мера хаоса или беспорядка в системе. Второй закон термодинамики гласит, что естественные процессы протекают таким образом, чтобы увеличивалась энтропия системы или оставалась постоянной. Следовательно, процессы, в которых энтропия уменьшается, являются невозможными без участия внешних факторов.
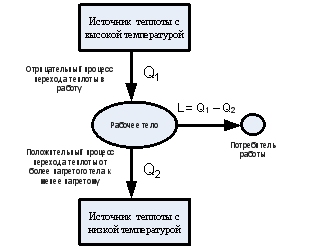
Также второй закон термодинамики устанавливает, что теплота не может самопроизвольно перетекать из тела с более низкой температурой в тело с более высокой температурой. Это означает, что процесс передачи тепла всегда требует затрат энергии или работы.
Второй закон термодинамики имеет фундаментальное значение во многих областях науки и технологий. Он объясняет, почему многие процессы необратимы, тем самым определяя направление энергетических процессов, таких как горение, охлаждение, циклы тепловых машин и другие. Второй закон также играет важную роль в статистической физике и изучении свойств макроскопических систем.
В итоге, второй закон термодинамики подтверждает необратимость и естественность процессов, наблюдаемых в природе, а также для понимания и развития технологий, связанных с энергетикой, тепловыми машинами, охлаждением и другими важными областями.
Определение и формулировка
Формулировка второго закона термодинамики:
1. Клаузиуса: В некоторых контактирующих термодинамических системах тепловой поток всегда происходит от системы с более высокой температурой к системе с более низкой температурой. Это означает, что невозможно создать такой процесс, в котором полностью будет преобразовано тепло, полученное из одной системы, в работу без источника тепла более высокой температуры.
2. Кельвина-Планка: Невозможно создать такой процесс, в котором единственным результатом было бы извлечение тепла из резервуара с постоянной температурой и использование его для совершения работы.
Определение второго закона термодинамики имеет фундаментальное значение для понимания протекания тепловых и энергетических процессов как в природе, так и в технологиях.
Базовое понятие
Энтропия — это мера беспорядка или хаоса в системе. Второй закон термодинамики утверждает, что естественные процессы направлены к увеличению энтропии. То есть, система всегда будет двигаться к состоянию с большей беспорядочностью.
Например, если рассмотреть кофе, который оставлен на столе, вначале он будет горячим, а затем остынет. Это происходит потому, что тепло передается от горячего тела (кофе) к холодному (воздух и стол). Этот процесс называется теплопроводностью и происходит из-за разницы в температурах. Со временем, температура кофе и окружающей среды будет выравниваться, что приведет к равновесию и увеличению энтропии системы.
Второй закон термодинамики также объясняет, почему машины и устройства, которые преобразуют энергию, не могут быть 100% эффективными. Например, двигатель внутреннего сгорания преобразует химическую энергию в тепловую и механическую энергию, но всегда происходят потери в виде тепла и трения, что увеличивает энтропию системы и снижает эффективность устройства.
Второй закон термодинамики имеет широкое применение в различных областях науки и техники, включая химию, физику, биологию и инженерию. Понимание этого закона позволяет разработать более эффективные процессы и технологии, а также помогает предсказать и объяснить поведение систем в различных сценариях.
Формулировка в классической термодинамике
Формулировка в классической термодинамике включает два основных утверждения:
1. Утверждение Клаузиуса: В равновесной термодинамической системе теплота сама не может из одного тела перейти в другое тело более низкой температуры без какого-либо внешнего воздействия.
То есть, теплота всегда самопроизвольно переходит от тела с более высокой температурой к телу с более низкой температурой. Это объясняет, почему лед тает в теплой комнате, а не образуется из атмосферного воздуха.
2. Утверждение Кельвина-Планка: Невозможно построить термодинамический процесс, в котором теплота, получаемая из одного резервуара, полностью превращается в работу, без потерь в виде тепла.
Это означает, что 100% эффективность в преобразовании тепловой энергии в механическую невозможна. Всегда будет часть теплоты, которая превратится в бесполезную для работы форму, и это связано с увеличением энтропии системы.
Таким образом, формулировка в классической термодинамике заключается в двух основных утверждениях, которые демонстрируют необратимость тепловых процессов и ограничения на преобразование тепловой энергии в работу.
Физическая природа закона
Энтропия – это мера беспорядка или хаоса в системе. Второй закон термодинамики говорит нам о том, что процессы, происходящие в закрытой системе, имеют тенденцию к более вероятным состояниям, к более равномерному распределению энергии и беспорядку.
Этот закон выражает фундаментальные физические принципы, связанные с направленностью времени и необратимостью процессов. Второй закон термодинамики объясняет, почему наблюдаемые в природе процессы имеют определенное направление и невозможны в обратном направлении.
В природе нет процессов, при которых тепло самих себя переходит от холодного тела к горячему, либо энергия сама собой переходит из хаотического состояния в упорядоченное. Это связано с тем, что второй закон термодинамики устанавливает неравновесные условия в системе и определяет ее эволюцию во времени.
Физическая природа закона заключается в сохранении энергии и распределении энергии в системе. Он призван объяснить, почему процессы происходят в определенном направлении и дают нам представление о том, какое количество работы может быть выполнено с помощью различных тепловых и холодильных машин.
Идея энтропии
Второй закон термодинамики утверждает, что в изолированной системе энтропия всегда должна увеличиваться или оставаться постоянной. Это означает, что процессы, которые приводят к увеличению энтропии, называются нереверсивыми или необратимыми. Например, когда лед тает, энтропия системы увеличивается, поскольку молекулы воды располагаются в более хаотичном порядке.
Энтропия имеет большое значение не только в физике, но и в других науках и технологиях. В химии и биологии, концепция энтропии используется для описания химических реакций и процессов жизни. В информационных технологиях, энтропия используется для измерения степени стихийности или случайности данных.
В целом, понимание энтропии позволяет нам лучше понять, как происходят процессы в природе и в технологиях. Это концепция, которая помогает нам объяснить, почему некоторые процессы необратимы и почему в нашей Вселенной существует необходимость в постоянном увеличении энтропии.
Необратимые процессы
Второй закон термодинамики определяет необратимые процессы в природе, которые характеризуются тем, что они не могут происходить в обратном направлении без дополнительных внешних воздействий.
Необратимые процессы играют важную роль в различных сферах жизни, включая технологии. Например, внутри двигателей внутреннего сгорания происходят необратимые процессы, которые преобразуют химическую энергию топлива в механическую энергию движения автомобиля.
Необратимость процессов также объясняет, почему невозможно создать систему, которая будет работать без потерь энергии. Все системы характеризуются энтропией, которая является мерой необратимости процессов. Энтропия всегда увеличивается с течением времени.
Понимание необратимых процессов позволяет разрабатывать более эффективные технологии, которые учитывают потери энергии, и может иметь важные приложения в области устойчивого развития и экологии.
Связь с другими законами
Второй закон термодинамики имеет тесную связь с другими законами физики и химии. Он вытекает из первого закона термодинамики, который гласит, что энергия в замкнутой системе не может быть создана или уничтожена, а может только превращаться из одной формы в другую.
Второй закон также связан с законом сохранения энергии, который утверждает, что общая энергия в изолированной системе остается постоянной. Если бы энергия в системе могла быть использована без потерь и можно было бы создать двигатель второго рода, нарушился бы закон сохранения энергии.
Также второй закон термодинамики связан с понятием энтропии. Энтропия — это мера беспорядка или хаоса в системе. Закон повышения энтропии гласит, что в изолированной системе энтропия всегда будет увеличиваться со временем.
Связь между законами физики и химии позволяет лучше понять и объяснить различные процессы и явления, происходящие в природе и технологиях. Второй закон термодинамики играет важную роль в энергетике, химических превращениях и теплообмене, а его связь с другими законами является основой для понимания многих явлений и процессов.
Первый закон термодинамики
Первый закон термодинамики, также известный как закон сохранения энергии для тепловых систем, устанавливает, что энергия не может быть создана или уничтожена, а может быть только преобразована из одной формы в другую или передана из одной системы в другую.
Этот закон является одним из фундаментальных принципов физики и находит широкое применение в различных областях науки и технологий. Он формализирует связь между внутренней энергией системы, работой, предоставленной системе, и теплотой, переданной системе или отданной системой.
Первый закон термодинамики может быть выражен в математической форме следующим образом:
| Для замкнутой системы: | Для открытой системы: |
|---|---|
| Q — W = ΔU | Q — W + ΔH = ΔU + ΔE_k + ΔE_p + ΔE_с |
Здесь Q представляет собой теплоту, переданную системе, W — работу, выполненную системой, ΔU — изменение внутренней энергии системы, ΔH — изменение энтальпии системы, ΔE_k — изменение кинетической энергии системы, ΔE_p — изменение потенциальной энергии системы, ΔE_с — изменение внутренней энергии системы (химических реакций).
Таким образом, первый закон термодинамики устанавливает, что энергия не может исчезать из системы, а может далее преобразовываться или передаваться для выполнения работы или нагревания.
Вопрос-ответ:
Какой смысл имеет второй закон термодинамики?
Второй закон термодинамики устанавливает, что в изолированной системе энтропия всегда увеличивается или остается постоянной со временем. Это означает, что процессы в природе направлены к более равномерному распределению энергии и более хаотическому состоянию системы. Закон указывает на необратимость многих процессов и объясняет, почему мы не можем создать полезную энергию из ничего.
Какой пример можно привести для объяснения второго закона термодинамики?
Давайте представим, что у нас есть комната, в которой одна сторона горячая, а другая сторона холодная. Если открыть дверь между сторонами, тепло (энергия) будет передаваться от горячей стороны к холодной, пока температура не выровняется. Этот процесс невозможно перевернуть: энергия не спонтанно переходит от холодной стороны к горячей. Это явление подчиняется второму закону термодинамики.
В каких технологиях второй закон термодинамики играет важную роль?
Второй закон термодинамики играет важную роль в многих технологических процессах, включая тепловые двигатели, холодильники, кондиционеры, электростанции и тепловые насосы. Это закон помогает оптимизировать эффективность работы этих систем и минимизировать потери энергии.
Как второй закон термодинамики относится к энтропии?
Второй закон термодинамики указывает на увеличение или постоянство энтропии в изолированной системе со временем. Энтропия является мерой хаоса или беспорядка в системе. Закон говорит нам, что процессы в природе приводят к увеличению энтропии и более хаотическому состоянию.
Как второй закон термодинамики объясняет необратимость процессов?
Второй закон термодинамики показывает, что некоторые процессы в природе невозможно перевернуть. Например, когда энергия тепла передается от горячего объекта к холодному, этот процесс невозможно перевернуть без внешнего вмешательства. Энергия не спонтанно переходит от холодного объекта к горячему. Таким образом, второй закон объясняет необратимость и направление процессов в природе.